1.L' acqua
1.2 - Le soluzioni acquose
Se vi sono incertezze riguardo le caratteristiche molecolari dell'acqua
liquida, la situazione per lo stato acquoso nei sistemi biologici pone
problemi ancora maggiori. L'acqua negli organismi viventi differisce infatti
dalla normale acqua per gli effetti associati alla presenza di sali ionici
ed altre sostanze chimiche ivi disciolte (vedi tabella 2), e per l'influenza
delle superfici macromolecolari.
| |
Na+ |
K+ |
Ca+ |
Mg+ |
Cl- |
| Invertebrati marini |
370 - 550 |
7 - 24 |
8 - 21 |
6 - 56 |
430 - 590 |
| Invertebrati terrestri |
3 - 262 |
1 - 46 |
2 - 47 |
6 - 188 |
15 - 270 |
| Rettili ed uccelli (plasma) |
130 - 180 |
3 - 6 |
2 - 6 |
1 - 2 |
103 - 148 |
| Mammiferi (plasma) |
145 - 166 |
3 - 6 |
2 - 10 |
1 - 2 |
100 - 116 |
Tab.2 ( mM / litro )
La distanza media che separa gli ioni in soluzione può essere
calcolata in funzione della concentrazione di soluto con l'equazione data
da Stokes e Robinson, basata su un modello geometrico che considera un
reticolo di ioni mediamente cubico nel tempo, e dove la distanza media
è data dall'equazione:
r = 0.95c-1/3
( 1.2 )
dove con c si rappresenta la concentrazione del sale in moli per litro.
In figura 10 è mostrato l'andamento della media distanza inter-ionica
in funzione della concentrazione molare di sale presente, in soluzioni
acquose di NaCl, e si vede chiaramente l'andamento espresso dalla formula
appena vista.
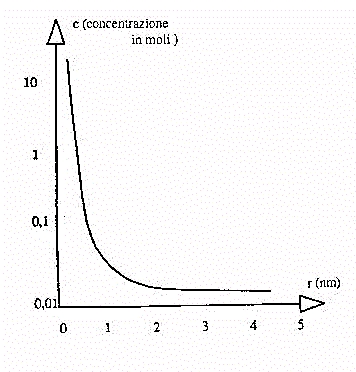 Fig.10 - Variazione
della distanza interionica media
Considerando la concentrazione di NaCl nei fluidi degli invertebrati marini,
mediamente pari a 0,5 moli/litro, si trova che gli ioni Na+
e Cl- distano tra loro di circa 1,20 nm.
Considerando anche il diametro di questi ioni si vede che rimane spazio
sufficiente per sole tre molecole d'acqua, tra gli ioni. Le dimensioni
medie di un grappolo di molecole d'acqua, nel liquido puro, vanno da 6
a 105 molecole. L'analisi ai raggi X ha
mostrato come la presenza di sali ionici modifichi la struttura del solvente
acqua in una soluzione. I modi più ovvi in cui gli ioni possono
influenzare l'orientamento delle molecole d'acqua sono quelli relativi
alla distruzione fisica implicata dalla sostituzione di una struttura chimica
estranea nel reticolo dell'acqua pura e quelli riguardanti l'interazione
elettrostatica tra la carica dello ione ed il momento di dipolo elettrico
delle molecole d'acqua circostanti. Gurney ha calcolato la mutua energia
potenziale elettrostatica tra un catione K+
ed il dipolo d'acqua, nel vuoto, separati dalla somma dei loro raggi di
Van der Waals, trovando un valore di -16,1 kcal/mole. Già da questo
valore ci si può rendere conto che nelle vicinanze di uno ione si
potrà osservare un drastico re-orientamento della struttura dell'acqua.
Di conseguenza, deve esistere una zona di disadattamento strutturale delle
molecole d'acqua tra una sfera d'idratazione più interna e l'acqua
più lontana imperturbata. Quest'idea ha condotto ad un modello per
le soluzioni acquose in cui sono individuate tre zone concentriche intorno
allo ione: una zona più interna di molecole d'acqua polarizzate,
relativamente immobili e legate elettricamente, una zona più esterna
dove il liquido ha la sua normale struttura, una intermedia di struttura
disadattata, dove alla tendenza ad assumere una struttura tetraedrica si
oppone la tendenza ad orientarsi radialmente dovuta alla presenza del campo
dello ione. Gli ioni potranno perciò essere classificati in base
alla loro capacità di favorire la struttura rinforzando le due zone
marginali, oppure quella di distruggere la struttura esaltando la zona
intermedia. Per ioni a bassa densità di carica, quali K+ o Cl-,
ci sono circa 12 molecole d'acqua nella co-sfera interna e 37 nella zona
intermedia di struttura disadattata. In accordo con il modello di Frank
ed Evans, il cambiamento d'entropia per una mole di acqua della co-sfera
interna è di circa -12 cal/grado, intorno agli ioni K+
e Cl-, mentre nella co-sfera intermedia
è rispettivamente di 12 e 10 calorie per grado. Da considerazioni
sui vari coefficiente ionici di viscosità, Von Hippel e Schleich
hanno concluso che gli ioni ad alta densità di carica incrementano
l'ordine della struttura, presumibilmente mediante un re-orientamento elettrostatico
e l'immobilizzazione delle molecole d'acqua confinanti. Appartengono a
questa categoria gli ioni Ba2+, Li+
, Ca2+, ed altri.D'altra parte
gli ioni monovalenti con un raggio largo, cioè di grandi dimensioni
atomiche, e quindi di bassa densità6
di carica, sembrano comportarsi come perturbatori della struttura, già
solo per le tensioni steriche7
implicate dalla sistemazione di questi ioni nel reticolo d'acqua. Tra tali
ioni si trovo il bromo, il cloro, l'indio, il potassio ed altri. Occorre
tuttavia procedere con cautela. Lo ione del fluoro, ad esempio, ha un raggio
ionico simile a quello del potassio, quindi è a bassa densità
di carica, ma si comporta in maniera abbastanza differente. Anche non considerando,
comunque, la presenza di ioni od altre sostanze chimiche disciolte, la
struttura dell'acqua pura sarà influenzata dalla presenza d'interfacce.
Ad esempio, in un volume sferico compatto, omogeneo, contenente 103
molecole d'acqua, almeno la metà si trova in superficie. Se si vuole
poter considerare trascurabile tale interazione è necessario avere
una sfera di diametro pari a circa 16,8 nm, ovvero un volume di 5*105
molecole. In questa maniera potremo considerare il comportamento del volume
come quello di un volume d'acqua pura. E' generalmente accettato il fatto
che le proprietà fisico-chimiche del liquido puro non esibiscono
anomalie termiche, poiché variano lentamente con la temperatura.
E' perciò interessante notare come invece l'acqua associata all'interfaccia
mostri tali anomalie. Per esempio la tensione superficiale dell'acqua nei
capillari mostra un'inflessione nelle sue variazioni di temperatura intorno
ai 15 °C. E' stata poi osservata un'anomalia intorno ai 31 °C tramite
misure effettuate con risonanza magnetica (N.M.R.) per quanto riguarda
i tempi di rilassamento dell'acqua in sospensioni colloidali. E' ragionevole
pensare che queste anomalie termiche siano il risultato dei cambiamenti
nella struttura dell'acqua determinati dalle influenze delle interfacce,
e che queste nuove strutture non assomiglino a quelle della normale acqua.
Anomalie termiche sono poi state riscontrate anche nei materiali biologici,
con caratteristiche concordi alle modellizzazioni fatte qui per le soluzioni.
Tali effetti della temperatura, osservati ad esempio negli studi sulle
reazioni enzimatiche, sulla conduzione ionica delle membrane, o sulla permeabilità
dei liposomi, possono essere considerati prove dell'esistenza di acqua
strutturata nei sistemi biologici, visto che è per questo tipo di
agglomerazione che gli stati strutturali variano, a volte "bruscamente",
con la temperatura. Le stime del contenuto di acqua "strutturata" nei sistemi
biologici dipendono, però, dalla tecnica fisica impiegata per determinarle
e questo ovviamente è un problema. Oggi i dati a disposizione spaziano
da valori in volume percentuale per l'acqua strutturata tra ~0%, 20% ed
80%, passando dalle misurazioni all'infrarosso a quelle tramite N.M.R..
Quest'ultima tecnica si ritiene sia un po' più affidabile (ma dà
comunque risultati che variano tra il 20% e l'80%). Le misurazioni all'infrarosso
infatti sembrerebbero insensibili ai cambiamenti di struttura, a causa
della presenza, nello spettro dei sistemi acquosi, di ampie bande d'assorbimento
sovrapposte. A tutta queste imprevedibilità si aggiunga che gli
effetti dei sali ionici sulle proprietà molecolari dell'acqua non
sono indipendenti da quelli delle superfici macromolecolari. Si può
immaginare che, in generale, l'acqua alla superficie di una molecola proteica,
in un tipico fluido biologico, si troverà anche nella sfera d'influenza
di almeno uno ione; l'effetto sarà dunque sempre una combinazione
dei due singoli contributi. L'interdipendenza dei potenziali termodinamici
dei componenti del sistema può essere rappresentata mediante l'equazione
di Gibbs-Duhem, e per il sistema proteina-acqua-sale, l'equazione può
essere scritta nella forma:
Fig.10 - Variazione
della distanza interionica media
Considerando la concentrazione di NaCl nei fluidi degli invertebrati marini,
mediamente pari a 0,5 moli/litro, si trova che gli ioni Na+
e Cl- distano tra loro di circa 1,20 nm.
Considerando anche il diametro di questi ioni si vede che rimane spazio
sufficiente per sole tre molecole d'acqua, tra gli ioni. Le dimensioni
medie di un grappolo di molecole d'acqua, nel liquido puro, vanno da 6
a 105 molecole. L'analisi ai raggi X ha
mostrato come la presenza di sali ionici modifichi la struttura del solvente
acqua in una soluzione. I modi più ovvi in cui gli ioni possono
influenzare l'orientamento delle molecole d'acqua sono quelli relativi
alla distruzione fisica implicata dalla sostituzione di una struttura chimica
estranea nel reticolo dell'acqua pura e quelli riguardanti l'interazione
elettrostatica tra la carica dello ione ed il momento di dipolo elettrico
delle molecole d'acqua circostanti. Gurney ha calcolato la mutua energia
potenziale elettrostatica tra un catione K+
ed il dipolo d'acqua, nel vuoto, separati dalla somma dei loro raggi di
Van der Waals, trovando un valore di -16,1 kcal/mole. Già da questo
valore ci si può rendere conto che nelle vicinanze di uno ione si
potrà osservare un drastico re-orientamento della struttura dell'acqua.
Di conseguenza, deve esistere una zona di disadattamento strutturale delle
molecole d'acqua tra una sfera d'idratazione più interna e l'acqua
più lontana imperturbata. Quest'idea ha condotto ad un modello per
le soluzioni acquose in cui sono individuate tre zone concentriche intorno
allo ione: una zona più interna di molecole d'acqua polarizzate,
relativamente immobili e legate elettricamente, una zona più esterna
dove il liquido ha la sua normale struttura, una intermedia di struttura
disadattata, dove alla tendenza ad assumere una struttura tetraedrica si
oppone la tendenza ad orientarsi radialmente dovuta alla presenza del campo
dello ione. Gli ioni potranno perciò essere classificati in base
alla loro capacità di favorire la struttura rinforzando le due zone
marginali, oppure quella di distruggere la struttura esaltando la zona
intermedia. Per ioni a bassa densità di carica, quali K+ o Cl-,
ci sono circa 12 molecole d'acqua nella co-sfera interna e 37 nella zona
intermedia di struttura disadattata. In accordo con il modello di Frank
ed Evans, il cambiamento d'entropia per una mole di acqua della co-sfera
interna è di circa -12 cal/grado, intorno agli ioni K+
e Cl-, mentre nella co-sfera intermedia
è rispettivamente di 12 e 10 calorie per grado. Da considerazioni
sui vari coefficiente ionici di viscosità, Von Hippel e Schleich
hanno concluso che gli ioni ad alta densità di carica incrementano
l'ordine della struttura, presumibilmente mediante un re-orientamento elettrostatico
e l'immobilizzazione delle molecole d'acqua confinanti. Appartengono a
questa categoria gli ioni Ba2+, Li+
, Ca2+, ed altri.D'altra parte
gli ioni monovalenti con un raggio largo, cioè di grandi dimensioni
atomiche, e quindi di bassa densità6
di carica, sembrano comportarsi come perturbatori della struttura, già
solo per le tensioni steriche7
implicate dalla sistemazione di questi ioni nel reticolo d'acqua. Tra tali
ioni si trovo il bromo, il cloro, l'indio, il potassio ed altri. Occorre
tuttavia procedere con cautela. Lo ione del fluoro, ad esempio, ha un raggio
ionico simile a quello del potassio, quindi è a bassa densità
di carica, ma si comporta in maniera abbastanza differente. Anche non considerando,
comunque, la presenza di ioni od altre sostanze chimiche disciolte, la
struttura dell'acqua pura sarà influenzata dalla presenza d'interfacce.
Ad esempio, in un volume sferico compatto, omogeneo, contenente 103
molecole d'acqua, almeno la metà si trova in superficie. Se si vuole
poter considerare trascurabile tale interazione è necessario avere
una sfera di diametro pari a circa 16,8 nm, ovvero un volume di 5*105
molecole. In questa maniera potremo considerare il comportamento del volume
come quello di un volume d'acqua pura. E' generalmente accettato il fatto
che le proprietà fisico-chimiche del liquido puro non esibiscono
anomalie termiche, poiché variano lentamente con la temperatura.
E' perciò interessante notare come invece l'acqua associata all'interfaccia
mostri tali anomalie. Per esempio la tensione superficiale dell'acqua nei
capillari mostra un'inflessione nelle sue variazioni di temperatura intorno
ai 15 °C. E' stata poi osservata un'anomalia intorno ai 31 °C tramite
misure effettuate con risonanza magnetica (N.M.R.) per quanto riguarda
i tempi di rilassamento dell'acqua in sospensioni colloidali. E' ragionevole
pensare che queste anomalie termiche siano il risultato dei cambiamenti
nella struttura dell'acqua determinati dalle influenze delle interfacce,
e che queste nuove strutture non assomiglino a quelle della normale acqua.
Anomalie termiche sono poi state riscontrate anche nei materiali biologici,
con caratteristiche concordi alle modellizzazioni fatte qui per le soluzioni.
Tali effetti della temperatura, osservati ad esempio negli studi sulle
reazioni enzimatiche, sulla conduzione ionica delle membrane, o sulla permeabilità
dei liposomi, possono essere considerati prove dell'esistenza di acqua
strutturata nei sistemi biologici, visto che è per questo tipo di
agglomerazione che gli stati strutturali variano, a volte "bruscamente",
con la temperatura. Le stime del contenuto di acqua "strutturata" nei sistemi
biologici dipendono, però, dalla tecnica fisica impiegata per determinarle
e questo ovviamente è un problema. Oggi i dati a disposizione spaziano
da valori in volume percentuale per l'acqua strutturata tra ~0%, 20% ed
80%, passando dalle misurazioni all'infrarosso a quelle tramite N.M.R..
Quest'ultima tecnica si ritiene sia un po' più affidabile (ma dà
comunque risultati che variano tra il 20% e l'80%). Le misurazioni all'infrarosso
infatti sembrerebbero insensibili ai cambiamenti di struttura, a causa
della presenza, nello spettro dei sistemi acquosi, di ampie bande d'assorbimento
sovrapposte. A tutta queste imprevedibilità si aggiunga che gli
effetti dei sali ionici sulle proprietà molecolari dell'acqua non
sono indipendenti da quelli delle superfici macromolecolari. Si può
immaginare che, in generale, l'acqua alla superficie di una molecola proteica,
in un tipico fluido biologico, si troverà anche nella sfera d'influenza
di almeno uno ione; l'effetto sarà dunque sempre una combinazione
dei due singoli contributi. L'interdipendenza dei potenziali termodinamici
dei componenti del sistema può essere rappresentata mediante l'equazione
di Gibbs-Duhem, e per il sistema proteina-acqua-sale, l'equazione può
essere scritta nella forma:
Npdmp
+ Nwdmw + Nsdms
= 0
( 1.3 )
dove N rappresenta il numero di moli di ogni sostanza,m
il potenziale chimico termodinamico, ed i pedici si riferiscono alle sostanze8.
Il cambiamento della componente salina in una soluzione proteica acquosa,
ad esempio, può cambiare mw
mediante interazione diretta tra sale ed acqua, attraverso un meccanismo
indiretto che coinvolge le proteine ed il sale, o come combinazione di
entrambi i processi. Le interazioni tra i sali e le soluzioni proteiche
più comuni e, nella pratica, più utili, sono quelle descritte
come effetti di salting in e salting out. Se un sale neutro è progressivamente
aggiunto ad una soluzione acquosa, si osservano due effetti macroscopici.
All'inizio la solubilità delle proteine aumenta (salting in) e quindi,
dopo aver raggiunto un massimo, inizia a diminuire di nuovo. L'effetto
di "salting in" può essere visto come un'interazione elettrostatica
non specifica tra le molecole proteiche, elettricamente cariche, e l'ambiente
ionico. Ciò provoca un netto decremento del coefficiente di attività
delle proteine, che si riflette in un incremento della solubilità
netta9. In prima
approssimazione, l'efficacia dei vari elettroliti relativamente all'effetto
di salting-in, non dipende dal tipo di ione, ma solo dalla forza ionica.
Viceversa l'efficacia nell'indurre l'effetto di salting out dipende fortemente
dal tipo di sale. Solfati, fosfati e citrati saranno caratterizzati da
alta efficacia molare relativamente al salting out, mentre cloridi ed acetati
saranno praticamente inefficaci. Superata la zona iniziale del salting
in, la solubilità S delle proteine (g/litro) in un sale avente concentrazione
c (moli/litro) è data dalla:
LogS = b-Kc
( 1.4 )
dove K è il coefficiente di salting out e è l'ipotetica solubilità
della proteina nell'acqua pura, in assenza di salting in. Mentre la solubilità
S può variare di molto in funzione del ph, della temperatura e del
tipo di proteina, K è praticamente indipendente da tutti questi
parametri e dipende praticamente solo dal tipo di sale preso in considerazione.
Essenzialmente ci sarà competizione tra tre forze d'organizzazione,
che cercano ognuna d'imporre un particolare e diverso tipo d'ordine nell'acqua
locale. Le forze dei gruppi non polari, degli ioni e dell'acqua imperturbata.
L'azione degli ioni, che tende a destabilizzare la struttura dell'acqua,
consiste nel far sì che meno acqua sia disponibile per formare strutture
a gabbia intorno ai gruppi non polari proteici, rispetto a quanta non ve
ne sia nel reticolo d'acqua imperturbata. Gli induttori di struttura hanno
invece la proprietà di allentare il reticolo dell'acqua imperturbata
e rendere così disponibile più acqua per l'organizzazione
intorno ai gruppi non polari. Questo modello indica che il tipo di riorganizzazione
della struttura dell'acqua indotta dagli ioni è irrilevante ai fini
della stabilità strutturale, mentre è importante capire l'entità
di questa ristrutturazione, l'estensione cioè della riorganizzazione
piuttosto che il tipo di meccanismo che sta agendo. Quest'ipotesi trova
fondamento negli studi condotti sugli effetti degli ioni che favoriscono
o perturbano la struttura dell'acqua, analizzati riguardo la stabilità
dei ribonucleidi. Infine, l'esistenza e l'estensione di una forma ordinata
d'acqua che differisce da quella dell'acqua normale, può essere
dedotta da esperimenti sul congelamento, che hanno lo scopo di rilevare
la presenza di cambiamenti di stato intorno agli 0 °C. Misure sulla
conducibilità ad 1 MHz per campioni di siero di albumina bovina
(BSA10) in forma
di polvere pressata, in funzione della temperatura e del contenuto d'acqua
sono mostrati in figura 11.
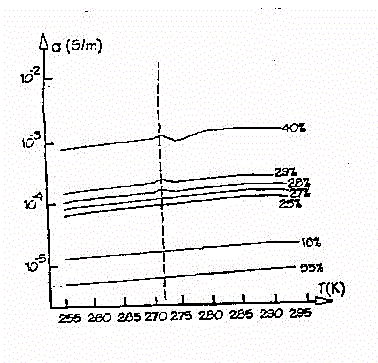 Fig.11 - Conducibilita'
della BSA con la temperatura
Fig.11 - Conducibilita'
della BSA con la temperatura
Per contenuti d'acqua minori del 28% in peso la conducibilità
in alternata dei campioni di BSA non mostrava discontinuità intorno
a 0 °C (indicata dalla linea tratteggiata verticale). E questo conferma
l'idea che una proporzione considerevole del contenuto d'acqua sia legata
alle proteine in modo tale da inibire la sua cristallizzazione in ghiaccio,
come si avrebbe per l'acqua normale a 0 °C. Da misure sul punto di
fusione dell'acqua solvente per BSA, caseina e collagene, i ricercatori
hanno trovato che circa il 50% in peso del contenuto d'acqua non partecipa
a nessun cambiamento di stato fino a -70 °C, ed hanno quindi supposto
che l'acqua, già a temperatura ambiente, abbia una struttura tipo
ghiaccio. Da misure mediante N.M.R. per collageni parzialmente idratati,
si è osservato che la mobilità rotazionale11
delle molecole d'acqua semplicemente decresce con la temperatura, di modo
che anche a -50 °C le molecole d'acqua mantengono una considerevole
libertà di rotazione. Inoltre da misure sull'assorbimento all'infrarosso
dell'acqua in campioni di DNA, usando una tecnica che riesce a distinguere
chiaramente il ghiaccio dall'acqua liquida, è stato trovato uno
strato interno di circa dieci molecole per nucleotide che non riesce a
cristallizzare nemmeno se circondato da acqua congelata. Questa guaina
interna mostra degli spettri d'allungamento come quelli dell'acqua normale.
Si può dunque concludere che l'acqua fortemente legata nei sistemi
biomolecolari non ha una struttura tipo ghiaccio, ma dovrebbe più
correttamente essere considerata come legata in modo tale da essere incapace
di assumere la struttura del ghiaccio senza un considerevole e termodinamicamente
sfavorevole re-arrangiamento molecolare.
Note
6 - Poiche' infattila materia è fondamentalemente
vuota, ad un aumento modesto della carica dovuto all'acquisizione di un
nuovo livello nella tavola periodica, non corrisponde un aumento di massa
tale da mantenere i rapporti volume-carica. Da qui la bassa densità
di carica di molti "grandi" elementi chimici.
7 - Cioe', ancora una volta, la tensioni
determinate dall'occupazione spaziale degli atomi o dei raggrupamenti atomici.
8 - P: protein (proteina); W: water (acqua);
S: salt (sale)
9 - Le molecole proteiche, cariche, vengono
attirate ed attirano gli ioni dell'ambiente ionico in cui sono poste. Questo
le rende meno reattive a livello elettrostatico. Se si considera allora
il numero di molecole solvate, si riscontra un aumento.
10 - Acronimo che sta per Bovine Serum
Albumine, ovver Siero di Albumina Bovina.
11 - La loro capacità, cioè,
di ruotare sul loro asse se immersi in un campo elettrico sinusoidale,
ad esempio.