L'unità fondamentale dei tessuti biologici è la cellula. Quest'ultima è costituita dalla membrana plasmatica, che rappresenta il rivestimento esterno della cellula, e regola l'ambiente interno consentendo il trasporto di sostanze dall'interno e dall'esterno. La membrana racchiude il nucleo, i mitocondri, l'apparato di Golgi e il reticolo endoplasmatico. Tutte queste strutture ne permettono il funzionamento. Nelle cellule vegetali si riscontra la presenza anche di un citoscheletro che la rende parzialmente più consistente.
Membrana cellulareLe membrane sono costituite prevalentemente da lipidi e proteine. I lipidi presenti sono caratterizzati da un gruppo di testa e un gruppo di coda. Le code sono delle lunghe catene di acidi grassi. La struttura di queste catene è molto simile a quella delle molecole dell'olio, e come l'olio e l'acqua tendono a separarsi in fasi diverse quando vengono mescolati, così le code delle molecole fosfolipidiche tendono ad allontanarsi dall'acqua. Per questo vengono definite idrofobe. D'altro canto le teste delle molecole fosfolipidiche, caratterizzate da una molecola di colina, un gruppo fosfato e una molecola di glicerolo sono solubili in acqua e sono definite idrofile. Nelle membrane i lipidi formano un doppio strato, disposto in modo che le teste idrofile costituiscano le superfici esterna ed interna della cellula a contatto con le fasi acquose e le code idrofobe rimangano all'interno della membrana.
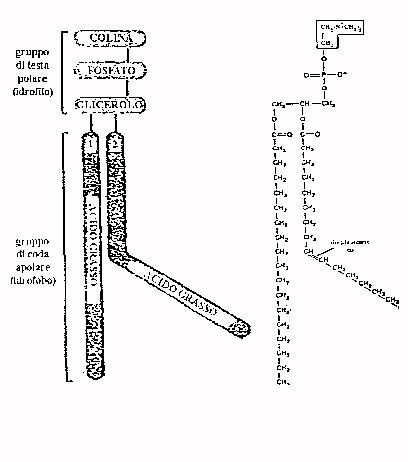
In figura si può osservare la struttura di un fosfolipide. Si vede la testa con un momento dipolare data dal gruppoO- e N+. Il gruppo fosfato CH-O permette sia alle teste sia a tutto il fosfolipide di ruotare. Si può così cambiare orientamento delle teste, inoltre è possibile che un fosfolipide che sta con la testa verso l'esterno, si ribalti e si posizioni con la testa verso l'interno. Questa operazione chiamata flip-flop, avviene comunque molto raramente, perchè il salto energetico tra interno ed esterno è elevato, richiedendo al fosfolipide una gran quantità di energia.
Andamento delle cariche tra l'interno e l'esterno della cellulaLa situazione teorica di equilibrio dinamico di una membrana, vista come un oggetto chimico inanimato, è sostanzialmente dovuta all'equilibrio tra le cariche interne ed esterne. Dalla tabella si notano le grandi differenze di concentrazione degli ioni fra interno ed esterno. Il calcio in particolare risulta essere in buona parte di tipo bloccato, ovvero residente nelle strutture intracellulari (mitocondri, reticolo endoplasmatico), per cui la quantità libera è in concentrazione molto bassa. La differenza di cariche crea una differenza di potenziale chiamata potenziale di membrana.
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
La cellula è in grado di funzionare con ben determinati livelli
di concentrazione di alcune sostanze come sodio, potassio e calcio. Quando
questo equilibrio viene turbato in un qualunque modo, interviene una struttura
chiamata pompa proteica, per ristabilire il giusto livello di concentrazioni.
La pompa proteica è formata da proteine transmembranali, ciascuna
delle quali è responsabile del trasporto di una determinata molecola
o di un determinato gruppo di molecole strettamente affini, attraverso
il doppio strato lipidico.

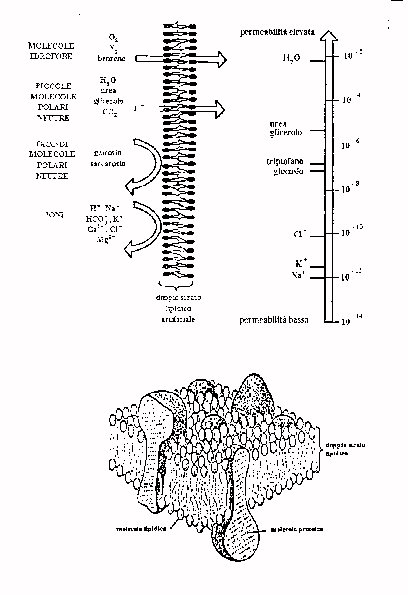
In ogni caso tutte le molecole possono attraversare per diffusione il doppio strato, mettendoci più o meno tempo a seconda della permeabilità della membrana. La attraversano più rapidamente molecole apolari e di piccole dimensioni. L'acqua è la molecola che attraversa la membrana più velocemente, a causa della sua struttura dipolare, che ne favorisce l'attraversamento di quelle regioni del doppio strato che contengono gruppi di testa lipidici, quindi idrorepellenti.
A differenza delle molecole apolari quelle polari hanno grande difficoltà a passare attraverso la membrana , riscontrando una permeabilità di circa 109 volte minore rispetto all'acqua. Ne sono un esempio le molecole di sodio (Na-) e di potassio (K+).
Le proteineLe proteine e le glicoproteine determinano la forma e la struttura della cellula e fungono da strumenti di riconoscimento molecolare e catalisi, permettendo alla cellula, tramite segnali e trasporto di materia, di comunicare col mondo esterno. Possiamo paragonare le proteine all'hardware di un computer ed il DNA al software. Le proteine derivano da un assortimento di 21 amminoacidi assai differenti, ciascuno dotato di proprietà chimiche distinte. Ed è questa varietà che rende conto dell'enorme versatilità di proprietà chimiche delle varie proteine. Molti dei legami di una catena polipeptidica consentono agli atomi che congiungono di ruotare liberamente, ciò conferisce all'ossatura della proteina una grande flessibilità. In teoria, perciò, una proteina potrebbe adottare un enorme numero di forme diverse, chiamate conformazioni. In effetti, nelle condizioni biologiche reali, la maggior parte delle catene laterali dei vari amminoacidi si associano fra loro e con l'acqua, formando deboli legami non covalenti. Di fatto, le catene laterali creano le condizioni per cui alcune conformazioni della proteina presentino caratteristiche di eccezionale stabilità.
Il risultato ultimo di tutte le singole alterazioni fra amminoacidi è che la maggior parte delle molecole proteiche si riavvolgono spontaneamente in una conformazione assolutamente unica e caratteristica, solitamente compatta e globulare, oppure fibrosa e allungata. Il nocciolo interno è costituito dall'aggregato delle catene laterali idrofobe, organizzate in una disposizione ravvicinata, mentre la superficie esterna, estremamente irregolare e complessa, è formata dalle catene laterali a carattere più spiccatamente polare.
Le proprietà chimiche di una proteina discendono quasi esclusivamente
dai residui che essa espone sulla propria superficie, e che sono capaci
di intrattenere vari tipi di legami deboli non covalenti con le altre molecole.
Per essere efficace, l'interazione fra una proteina e altre molecole (dette
ligandi) richiede la formazione simultanea di un certo numero
![]()
di legami deboli (tipo legame idrogeno o Van der Waals), e ciò vuol dire che i soli ligandi che possono associarsi strettamente alla alla proteina sono quelli che riescono ad adattarsi esattamente alla sua superficie. Solitamente la regione di una proteina destinata a fissare il ligando, chiamato sito di legame o sito attivo, assume la forma di cavità.
Queste regioni se alterate con sostanze chimiche cariche elettricamente, come calcio o sodio, esercitano delle forze sulle molecole circostanti che chiudono il sito.
Ad esempio, il meccanismo per cui il curaro blocca il canale dell'acetilcolina è basato su questo principio, ovvero il curaro blocca il sito attivo e impedisce il flusso delle cariche nella membrana.
Un esempio di proteina è la glicoforina, come si vede dalla figura, una parte della proteina attraversa la membrana mentre la restante parte è all'esterno. Come ogni proteina è sostanzialmente carica nella parte esterna, ed è questa proprietà che le permette di riconoscere le sostanze, come è stato descritto precedentemente.
Grosso modo le proteine di membrana possono venire classificate in due categorie in base alla forma che assumono a livello dell'interno idrocarburico. Nella prima categoria la forma è bastoncellare con uno stretto avvolgimento a elica e pertanto la molecola è detta a-elica. Nell' a-elica, gli amminoacidi che costituiscono la catena polipeptidica sono disposti in modo tale che lo scheletro della molecola sia appunto avvolto ad elica, mentre le catene laterali degli amminoacidi sono proiettate verso l'esterno.
La seconda categoria di proteine di membrana sembra avere sostanzialmente, all'interno della regione idrofoba della membrana, una struttura globulare. Un esempio di queste strutture è data dalla lisozima dell'albume dell'uovo. In figura possiamo vedere la conformazione tridimensionale di questa proteina nelle quattro rappresentazioni più comuni.
Il primo è un modello a spazio pieno che mette in evidenza i raggi degli atomi, nel secondo si vedono i segmenti che collegano i vari atomi lungo lo scheletro polipeptidico, nella terza si evidenziano schemi di ripiegamento che ricorrono ripetutamente in porzioni della proteina, questi schemi vengono chiamati piani ß (le frecce) ed eliche a, nella quarta si vede la conformazione spaziale della catena polipeptidica nel suo complesso.
![]()
![]()
Un esempio di proteina ad a-elica è la rodopsina, rappresentata in figura. La catena proteica attraversa il doppio strato lipidico della membrana (nel caso specifico questo avviene sette volte) con una struttura elicoidale, le terminazioni esterne alla membrana sono elettricamente e termicamente sensibili. Un'azione elettrica o termica su tali terminazioni può provocare una deformazione della struttura della catena proteica.
Un'altra proprietà delle proteine è la possibilità di aggregarsi autonomamente, in strutture grandi dimensioni. Se una proteina possiede un sito di legame complementare a un'altra regione della propria stessa superficie, essa si organizza spontaneamente in una struttura aggregata. Il caso più semplice è quello in cui il sito di legame si riconosce e da vita ad un dimero simmetrico. Molti enzimi e anche altre proteine formano dimeri di questo tipo, che fungono di sovente da subunità nella formazione di strutture aggregate più ampie.
![]()
Meccanismi di trasporto di sostanze attraverso la membrana. Canali ionici.Vediamo ora i metodi utilizzati dalle proteine transmembraniche (chiamate proteine vettrici) per permettere il trasferimento di informazioni tra l'interno e l'esterno della cellula.
Numerose proteine vettrici della membrana fanno si che determinati soluti attraversino il doppio strato lipidico mediante un meccanismo detto di trasporto passivo. Posto che la molecola da trasportare sia priva di carica elettrica, a determinare il verso del trasporto passivo sarà semplicemente la differenza di concentrazione sui due lati della membrana (ovvero il gradiente di concentrazione). Se, invece, il soluto è dotato di carica elettrica, allora concorreranno a questo fine sia il gradiente di concentrazione sia il gradiente di potenziale elettrico totale (potenziale di membrana).
Alcune delle proteine vettrici che mediano il trasporto passivo danno
origine a canali o pori acquosi i quali permettono ai soluti di dimensione
e carica appropriate di attraversare la membrana per semplice diffusione.
Altre proteine funzionano come pompe che pilotano attivamente il movimento
di determinati soluti contro i rispettivi gradienti elettrochimici, mediante
il cosiddetto trasporto attivo. Questi trasporto deve essere associato
ad una fonte di energia metabolica. Il più delle volte ciò
implica l'idrolisi di ATP (adenosintrifosfato).
![]()
I canali ionici a sbarramento, consentono agli ioni di passare, seguendo i rispettivi gradienti elettrochimici, solo a condizione che le proteine si trovino nelle proprie configurazioni "aperte". Canali di questo genere sono :
a) la presenza del ligando modifica la struttura del canale, che si apre permettendo il passaggio di sostanze in presenza di un gradiente elettrochimico.
b) quando la membrana si depolarizza, il canale si apre; anche in questo caso il passaggio di sostanza è regolato dalla presenza di un gradiente elettrochimico.
Da tutto si evince che i canali non sono direzionali, essi permettono il passaggio di sostanze, passaggio che poi è legato alla presenza o meno di un gradiente elettrochimico.
Evidentemente dovranno esistere dei meccanismi di chiusura dei canali (rimozione del ligando in un caso e ristabilizzazione del potenziale di resting nell'altro).
Il modello di Hodgkin-Huxley (modello di neurone) evidenzia l'esistenza di canali a controllo di potenziale che si aprono in corrispondenza a valori diversi di potenziale di membrana.
Se la situazione di equilibrio di una cellula corrisponde ad una certa differenza di potenziale ai capi della membrana, l'allontanamento da tale stato di equilibrio in seguito all'apertura dei canali impone alla cellula stessa la capacità di ritornare in fase di resting nel più breve tempo possibile, pena la sua sopravvivenza.
Stati configurazionali di una proteina
Per comprendere meglio il meccanismo di apertura e chiusura di un canale si deve comprendere la proprietà delle molecole proteiche di assumere configurazioni diverse se opportunamente rifornite di energia. Osservando il comportamento di una proteina allosterica camminatrice notiamo che essa è capace di assumere tre diverse configurazioni. Se nulla intervenisse a pilotare ordinatamente i suddetti mutamenti conformazionali, ogni cambiamento di forma sarebbe perfettamente reversibile e la proteina vagherebbe disordinatamente avanti e indietro senza meta logica per mezzo dell'energia fornita tramite agitazione termica.
Un meccanismo di controllo del ciclo degli stati configurazionali di una molecola è la fosforilazione. Un atomo di fosforo può interagire elettricamente con una molecola proteica inattiva modificandone la struttura e rendendo possibile il passaggio solo ad un altro determinato stato configurazionale in cui si crea un sito attivo. La fosforilazione quindi sospinge la molecola nella sua configurazione attiva, ciò può indebolire il legame con il fosforo che viene perciò liberato.
Pompa sodio-potassioLa pompa Na-K si può considerare un esempio del meccanismo appena descritto. Tale pompa trasferisce sodio e potassio rispettivamente dall'interno all'esterno e dall'esterno all'interno della membrana contro il gradiente della concentrazione, compiendo quindi un lavoro, giocando sui meccanismi configurazionali. Questo lavoro della pompa serve a ristabilire e mantenere le giuste concentrazioni di ioni sodio e potassio nella cellula. Nella figura è rappresentata la pompa in forma dimera (due unità), mentre nella membrana è possibile che essa esista come tetramero costituito da due unità piccole e due grandi.
Passiamo ora all'analisi del ciclo della pompa Na-K. In figura possiamo vedere i vari passi seguiti dalla pompa per il trasporto degli ioni. S parte dalla disponibiltà del citoplasma di un sito attivo per il sodio [1], in seguito ad una conversione ATP-ADP, il sodio si lega alla proteina [2]; si ha allora una fosforilazione che provoca una mutazione configurazionale tale che il sodio non ha più motivazioni energetiche per restare legato e viene perciò liberato all'esterno della membrana [3].
Per ogni ciclo la pompa espelle tre ioni sodio e assume due ioni potassio per ogni molecola di ATP che si idrolizza .
Un sito attivo si rende ora disponibile per il potassio presente all'esterno della membrana [4], ciò fa si che io potassio si leghi con la molecola proteica producendo una defosforilazione [5] che porta la molecola proteica nella configurazione originaria. Configurazione nella quale il potassio non ha più motivazioni energetiche per rimanere legato e viene quindi liberato all'interno della membrana [6].
L'energia spesa per compiere lavoro contro i gradienti di concentrazione del sodio e del potassio è fornita dalla conversione ATP-ADP.
In generale diverse sostanze possono legarsi ad uno stesso sito attivo, ma non è detto che tutte si stacchino da esso negli stessi stati configurazionali.
Alcune sostanze possono formare dei legami molto stabili occupando così permanentemente il canale e rendendolo inutilizzabile ( si veda l'esempio citato del curaro).
E' da sottolineare l'importanza del colesterolo, che influenza la robustezza e l'elasticità della membrana. Un eccesso di colesterolo nella membrana rende quest'ultima più rigida e i canali si aprono con più difficoltà.
Cellule nervose
La singola cellula nervosa si compone di una parte centrale (soma) e di una serie di tentacoli (dendriti e assone). Le cellule di tipo nervoso tendono a crescere, allungando l'assone ed i dendriti finchè non incontrano un'altra cellula con cui mettersi in contatto.
Compito delle cellule nervose è ricevere delle informazioni, trasmetterle per tutto il corpo, coordinarle e integrarle.
Giunzione neuromuscolareVediamo ora qual'è il meccanismo utilizzato dalle cellule nervose per trasferire informazione ad un tessuto muscolare. Nel collegamento possiamo riscontrare diversi tipi di canali ionici:
La presenza del calcio crea le condizioni per l'apertura delle vescicole contenenti acetilcolina verso l'esterno [2]. Le molecole di acetilcolina vanno a legarsi ai canali Na-K a controllo di acetilcolina della cellula e il canale si apre agli ioni Na-K.
A questo punto [3] si ha una prima depolarizzazione della membrana che apre i canali a controllo di potenziale che favoriscono ancora di più l'afflusso di sodio all'interno della membrana. Questo provoca [4] anche la liberazione dal reticolo sarcoplasmatico che rende possibile la contrazione del muscolo. A questo punto, in seguito alla variazione di potenziale della membrana, entrano in azione pompe Na-K ed i canali del calcio (non presenti nella figura), permettendo agli ioni calcio in eccesso nel citoplasma di fuoriuscire dalla cellula. Inoltre l'acetilcolina comincia a staccarsi dai suoi siti recettori facendo richiudere i canali Na-K. Un enzima, l'acetilcolinesterosi, preleva l'acetilcolina e la reimmette nel ciclo metabolico. A questo punto il potenziale, ristabilendosi, fa richiudere i canali a controllo di potenziale. In realtà in tutto questo processo interviene un fenomeno di "stanchezza" del canale Na-K che, dopo aver rilasciato l'acetilcolina, per un certo periodo di tempo non è in grado di legarla nuovamente permettendo così all'acetilcolinesterosi di allontanrla definitivamente.
Duplicazione cellulareAnche la duplicazione come tutti i fenomeni riguardanti la cellula è controllata da trasmissione di ioni. Dall'esterno della cellula arriva una trasmissione di calcio che penetra nel nucleo e provoca il liberarsi di enzimi (DNA-polimerasi) che svolge completamente il DNA. Poi iniziando da un'estremità, ogni catena costituisce una catena complementare e precisamente l'adenina si unirà con la timina, la citosina con la guanina e così via, per tutta la sequenza polinucleotidica. Le nuove basi così fornite rimangono attaccate al filamento da cui sono originate ripristinando in tal modo la doppia elica. A questo punto il nucleo con i due DNA si separa.
Tutto il meccanismo è attivato dalla membrana cellulare, ossia si può attivare esternamente con delle sostanze chimiche che vanno ad agire sulla membrana cellulare.
Breve cenno sui liposomiSperimentalmente si è visto che esistono una serie di effetti non termici da campi EM sui sistemibiologici, si tratterà ora di capire come può un campo, anche se di bassa intensità, modificare dei meccanismi complessi come quelli appena esaminati.
Il probòema è quello di arrivare ad un modello di membrana senza dover tenere conto di tutto quello che c'è in una membrana reale. Per fare ciò si possono usare diversi schemi sperimentali. Il più semplice si basa sull'utilizzazione di liposomi (doppio strato fosfolipidico artificiale) costruiti in laboratorio. Questi liposomi riempiti con soluzioni di proteine o altro genere, permettono con ottima approssimazione di esaminare gli effetti dei campi EM su di esse come se fossero delle vere cellule. I risultati di questi esperimenti si possono trovare in letteratura.
![]()