Cap. 6 L'accesso ai canali ionici
6.2 Il canale dell'acetilcolina
Nel tentativo di comprendere cosa accada a livello di membrana, e quindi in particolare di singolo canale, occorre, in riferimento alla figura 26, spingersi a livello di biofisica della membrana.
L’accesso a strutture così microscopiche come i canali, è stato reso possibile dall’introduzione di una rivoluzionaria tecnica (1976), detta del "patch clamp". Per la messa a punto di questa tecnica, che ha richiesto anni di elaborazione e perfezionamento, gli autori, Sakmann e Neher sono stati insigniti del premio Nobel nel 1991. Si faccia riferimento alla figura 38.
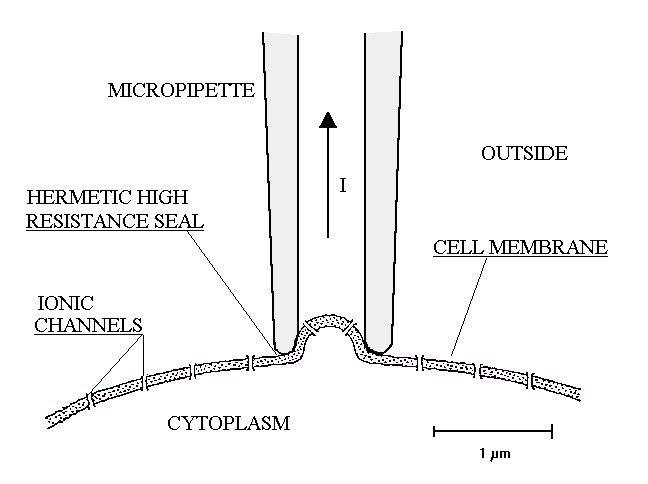
Figura 38
La tecnica del patch-clamp consiste nel fare aderire la punta di una sottilissima pipetta di vetro ad una membrana cellulare, in modo da isolare una piccola area della membrana stessa e i canali ionici in essa presenti. Ciò consentirebbe in teoria di osservare l’attività di un ristrettissimo numero di canali. Purtroppo inizialmente non fu facile ottenere una perfetta saldatura tra la micropipetta e la membrana e si dovettero tollerare delle perdite di corrente tra il fluido extracellulare e l’interno della pipetta. Alcuni anni dopo però si scoprì che bastava praticare una lieve aspirazione attraverso la pipetta per portare la resistenza della saldatura a più di un miliardo di ohm (figura 39).
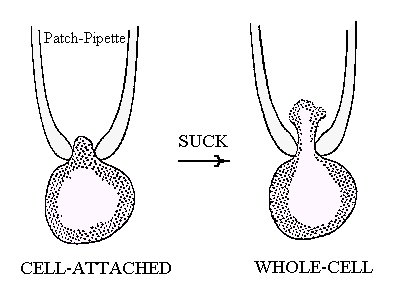
Figura 39
Occorre inoltre mettere in evidenza il fatto che la regione interessata è talmente piccola da poter ritenere che il funzionamento della cellula non venga per niente alterato dalla presenza della micropipetta. In sostanza ciò che viene fatto è misurare la corrente attraverso i pochi canali contenuti nella zona selezionata, ottenendo un segnale come quello mostrato in figura 40.
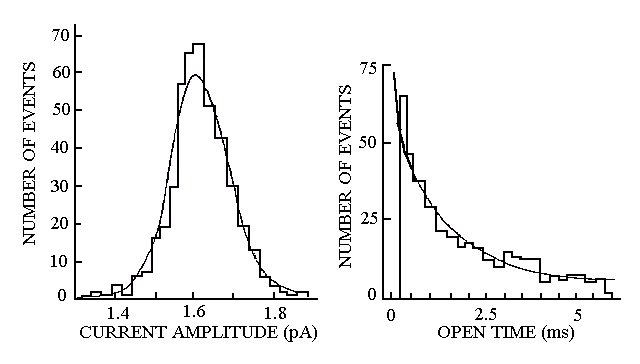
Figura 40
Si osserva la presenza di due livelli; inizialmente non si ha un flusso di corrente perché tutti i canali sono evidentemente chiusi. Quando, in seguito all’instaurarsi di una differenza di potenziale o alla comparsa di un qualche agente chimico, un canale passa allo stato aperto, è possibile registrare improvvisamente un passaggio di corrente di circa 2.5 pA. Dopo un periodo di tempo variabile, la molecola che forma il canale ritorna allo stato chiuso e la corrente non fluisce più.
E’ possibile allora valutare il tempo di apertura del canale (t0: tempo in cui ciascun canale resta aperto), il tempo di chiusura (tc: tempo intercorrente tra un'apertura e la successiva), nonché l’ampiezza della corrente che scorre. Si osserva poi che, variando il potenziale tra esterno ed interno della membrana, la corrente aumenta a segnalare che la conduttanza del canale rimane invariata.
In qualche minuto di osservazione si riesce ad avere un numero sufficientemente grande di aperture, e dunque, facendo degli studi statistici, ad individuare famiglie diverse di canali. Le proprietà funzionali vengono messe in relazione con la struttura del canale, nel senso che caratteristiche fisiche differenti determinano per esempio diversi tempi di apertura o conduttanze diverse.
La statistica che si ricava è sostanzialmente quella di figura 41.
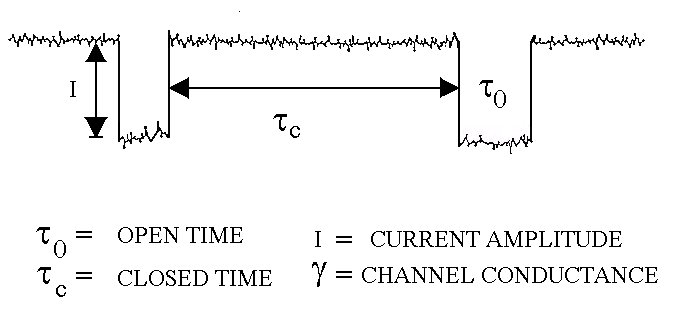
Figura 41
La tecnica del patch-clamp consente allora un’analisi a livello microscopico che, altrimenti, non potrebbe essere condotta. Viene spesso impiegata nello studio di soggetti affetti da distrofia muscolare, laddove il canale dell’acetilcolina ha problemi funzionali. Quest’ultimo è fortemente studiato in letteratura ed esistono modelli matematici che ne simulano il comportamento.